Соловьева А.В.1, Фаткуллин И.Ф.2, Ахметгалиев А.Р.2, Винокурова Е.А.3, Алейникова Е.Ю.1, Кузнецова О.А.1
1Федеральное государственное автономное образовательное учреждение высшего профессионального образования РОССИЙСКИЙ УНИВЕРСИТЕТ ДРУЖБЫ НАРОДОВ (Медицинский институт) Министерства образования и науки Российской Федерации. Кафедра акушерства и гинекологии с курсом перинатологии, (зав. кафедрой член-корр. РАН, проф. Радзинский В.Е.) 117198, город Москва, ул. Миклухо-Маклая, дом 8.
2Федеральное государственное бюджетное образовательное учреждение высшего образования "Казанский государственный медицинский университет" Министерства здравоохранения Российской Федерации Кафедра акушерства и гинекологии им. профессора В.С. Груздева, 420012, Республика Татарстан, г. Казань, ул. Бутлерова, д.49, телефон 8 (843) 236-06-52.
3ФГБОУ ВО Тюменский ГМУ Минздрава России - Федеральное государственное бюджетное образовательное учреждение высшего образования Тюменский государственный медицинский университет Министерства здравоохранения Российской Федерации, г. Тюмень, Кафедра акушерства и гинекологии, 625023, г. Тюмень, ул. Одесская, 54, телефон 8(3452) 20-40-47.
Аннотация
Проведено описательное исследование оценки эффективности модификации образа жизни (диета и физические нагрузки) с включением нутритивной поддержки комбинации 1000 мг миоинозитола и 200 мг D-хироинозитола (соотношение 5:1) у 353 женщин репродуктивного возраста с АМК, избыточной массой тела или ожирением на протяжении 2-4 месяцев. Выявлены: значительное укорочение МЦ до его физиологических параметров – длительность 31±12,04 (на 1 визите 44±19,51, р=0,001), уменьшение частоты обильных кровянистых выделений в 2,57 раза (р=0,001), увеличение частоты умеренных кровянистых выделений в 1,62 раза (р=0,001), увеличение доли пациенток с регулярным МЦ в 2,69 раза (р=0,001). Это сопровождалось также снижением массы тела (-3 кг, р=0,001), уменьшением окружности талии (-2,5см, р=0,001). Лабораторные тесты показали снижение содержания глюкозы в сыворотке крови (-1,3 ммоль/л, р<0,05), снижение свободного тестостерона (-0,4 пг/л, р<0,05), увеличение ФСГ (+0,1 мМЕ/мл, р<0,05) и снижение ЛГ (-0,8 мМЕ/мл р<0,05). Результаты исследования позволяют рекомендовать женщинам с ожирением и избыточной массой тела, страдающим АМК-О, в составе комплексной терапии средство Дикироген, содержащее МИ и ДХИ в соотношении 5:1.
Введение
Аномальные маточные кровотечения (АМК) в репродуктивном возрасте имеют значительное влияние на здоровье женщин, и встречаются с частотой до 30%1.
Традиционно АМК определяется как кровотечение свыше 80 мл в течение одного менструального цикла при объективном измерении2, 3. Однако диагноз АМК обычно основан на личном восприятии объема менструальной кровопотери и его отрицательном влиянии на повседневную жизнь: ограничение двигательной активности, повседневной деятельности, профессиональных функций и социальных взаимодействий4, 5.
АМК бывает как при овуляторном, так и ановуляторном циклах. АМК на фоне овуляторного цикла характеризуется обильными, регулярными менструальными кровотечениями, возникающими между 21 и 32 днями, тогда как в ановуляторных циклах обильное, часто продолжительное кровотечение происходит с интервалом 35 и более дней6. Имеющиеся данные свидетельствуют о том, что около половины больных женщин не обращаются за медицинской помощью, даже если она доступна. Анемизация женщин с АМК и нарушения здоровья (усталость, вялость, одышка при физической нагрузке) значительно снижают производительность труда, нарушают нормальную повседневную жизнь и влияют на социальное и эмоциональное благополучие женщин7,8.
В 2011 году, признавая назревшую необходимость, Международная федерация гинекологии и акушерства (FIGO) опубликовала классификацию PALM-COEIN и клинические рекомендации с целью оказания помощи клиницистам в установлении диагноза, диагностических мероприятий и терапии АМК в репродуктивном возрасте9. В 2018 году была представлены изменения в системе PALM-COEIN1 но, по мнению, ряда исследователей нынешнее понимание механизмов менструальных кровотечений, а также многих патологических процессов АМК является неполным. Любой процесс, который нарушает нормальную эндокринную, паракринную или гемостатическую функции эндометрия, а также, любое вмешательство в сократительную способность миометрия, может вызвать АМК7. По мнению ряда авторов функциональные нарушения, в том числе и овуляторная дисфункция, являются самой частой причиной АМК, и составляют 76%10. Наиболее часто к ановуляции и нарушениям менструального цикла приводят синдром поликистозных яичников (СПКЯ), метаболический синдром, избыточная масса тела, ожирение, гиперпролактинемия, заболевания щитовидной железы. Все более распространенным заболеванием, которое нарушает нормальное гормональное равновесие в эндометрии, является ожирение11, наибольшее неблагоприятное влияние имеет висцеральное отложение жира (на талии)12. Превращение андростендиона, секретируемого надпочечниками, в эстрон ароматазой в жировой ткани обеспечивает важный источник дополнительного эстрогена для эндометрия13, 14. Это приводит к чрезмерному росту эндометрия, обусловленному эстрогенами, и часто вызывает АМК, связанные с отторжением гиперплазированного функционального слоя. Наиболее эффективным методом восстановления менструального цикла при ожирении является редукция веса. Недавно было показано, что комбинация инозитолов (миоинозитола (МИ) и D-хироинозитол (ДХИ) имела хорошие результаты в отношении потери массы тела, частоты овуляции и наступления беременности у женщин с СПКЯ (ожирением, ановуляцией и гиперандрогенемией)15. МИ и ДХИ являются вторичными мессенджерами, передающими сигналы от рецепторов фолликулостимулирующего гормона, лютеинезирующего гормона, гонадотропин-рилизинг гормона и инсулина, т.е. участвуют в регуляции действия половых гормонов и инсулина16, 17.
Дополнительным свойством инозитолов является влияние на синтез грелина, что способствует снижению аппетита17. Кроме того при пероральном применении инозитолы хорошо переносятся18, 19 и практически не имеют побочных эффектов.
С целью изучения влияния миоинозитола и D-хироинозитола в соотношении 5:1 в сочетании с диетой и физическими упражнениями на регуляцию менструального цикла у женщин с избыточной массой тела и ожирением на базе клиник г. Москвы, г. Казани и г. Тюмени на протяжении 2020-2021 г.г. было проведено обсервационное описательное исследование. Под наблюдением находились 353 женщины.
Критерии включение: АМК, избыточная масса тела или ожирение, окружность талии более 80 см, отсутствие приема гормональных препаратов в течение 3 месяцев до включения в исследование, отсутствие заболеваний, требующих хирургического лечения, отсутствие заболеваний, требующих систематического приема лекарственных препаратов.
Критерии эффективности: регулярность менструального цикла, индекс массы тела (ИМТ), окружность талии (ОТ), уровень глюкозы в сыворотке крови, уровень свободного тестостерона, ФСГ, ЛГ.
Всем женщинам в качестве 1 линии терапии рекомендовали модификацию образа жизни – физические упражнения и правильное питание (но основании представленных дневников питания). В качестве нутритивной поддержки рекомендована комбинация МИ и ДХИ в соотношении 5:1 (Дикироген, производство Pizeta Pharma, номер свидетельство о государственной регистрации RU.77.99.88.003.R.003252.09.19, содержащий 1000 мг МИ и 200 мг ДХИ) по схеме: по 1 пакетику 2 раза в день после приема пищи, предварительно разбавляя пакетик в ½ стакана воды. В состав Дикирогена входит также 200 мкг фолиевой кислоты и 5 мг марганца в форме органической соли – марганца пидолата ( в связи с тем, что фолиевая кислота и марганец являются синергистами инозитолов)17.
При первичном обследовании и на протяжении приема комбинации МИ и ДХИ (в соотношении 5:1) у женщины оценивали: массу тела, рост, ИМТ, ОТ, характеристики менструального цикла (длительность менструальных выделений, объем кровопотери, регулярность, продолжительность). Лабораторные методы исследования включали определение в сыворотке крови глюкозы натощак, а также на 2-5 дни менструального цикла ФСГ, ЛГ, свободного тестостерона. Второй визит был запланирован через 2-4 месяца после первичного осмотра.
Статистический анализ полученных данных проводили при помощи программы IBM SPSS Statistics V. 16. Оценка достоверности проводилась тестом Уилкоксона для непараметрических показателей.
Результаты и обсуждение полученных результатов
При анализе антропометрических параметров 353 женщин с АМК было установлено, что медиана (Ме) возраста пациенток составляла 31 (±5,213) лет при минимальном возрасте 18 лет и максимальном 46 лет.
Масса тела женщин в среднем была 83 (±12,22) кг при минимальной массе 58 кг и максимальной - 138 кг. ИМТ находился в пределах 25–47,75 кг/м2, в среднем 30,39 (±4,16) кг/м2. Окружность талии (ОТ) составляла 90 (±12,09) см.
Избыточную массу тела имели 39,66% (140 женщин), ожирение той или иной степени было у 60,34% (213 женщины), ожирение 1-й степени у 39,09% (138 женщин). Абдоминально-висцеральное ожирение (ОТ>80 см) выявили у 86,97% (307 женщин).
Средний возраст менархе был 13 (±1,6) лет; минимальный возраст – 10 лет, максимальный 21 год. На момент первичного осмотра регулярный МЦ был у 30,88% (109) пациенток, а средняя длительность МЦ составляла 44 (±19,51) дней. Ациклические маточные кровотечения были у 244 (69,12%) пациенток. Умеренными определяли свои кровянистые выделения при менструации 193 (54,67%) женщины, обильными 87 (24,65%), скудными 68 (19,26%), и менструации отсутствовали в течение 3-6 месяцев у 5 (1,42%) пациенток.
Уровень глюкозы натощак в среднем составлял 5,2 (±0,76) ммоль/л, при этом минимальное значение – 3,1 ммоль/л, а максимальное – 9,8 ммоль/л. При первичном обследовании андрогенного статуса установили, что средний уровень свободного тестостерона был равен 2,20 (±2,09) пг/л. Уровни же ФСГ и ЛГ в среднем составляли 6,10 +/- 7,68 (мМЕ/мл) и 7 +/- 5,1 (мМЕ/мл) соответственно.
На 2-м визите (Медиана между визитами 64 (±21,62) дня, минимум 31 и максимум 136 дней) зафиксировано изменение ИМТ и уменьшение параметра на 1,33 кг/м2 (29,06 (±4,2) кг/м2), (р<0,05) (табл. 1).
Таблица 1. Результаты сравнительного изменения массы тела, индекса массы тела (ИМТ), окружности талии по отношению к исходному.
| Визит | Изменение параметра |
Wilcoxon Matched Pairs Test, p |
|
| 1 | 2 | ||
| Масса тела (кг) | |||
| 83 (±12,22) | 80 (±11,98) | -3,0 | 0,001 |
| ИМТ (кг/м2) | |||
| 30,39 (±4,16) | 29,06 (±4,2) | - 1,33 | 0,001 |
| ОТ (см) | |||
| 90 (±12,09) | 87,5(±10,79) | -2,5 | 0,001 |
Показатели медианы массы тела также статистически значимо снизились до 80 (±11,98) кг (табл. 1).
На втором визите также было зафиксировано статистически значимое (р<0,05) уменьшение параметра медианы окружности талии на 2,5 см (87,5(±10,79)см) (табл. 1), а количество пациенток с абдоминально-висцеральным ожирением уменьшилось на 7,37% до 281 (79,6%).
Таблица 2. Результаты сравнительного изменения параметров менструального цикла по отношению к исходному.
| Параметры МЦ | Визиты |
Wilcoxon Matched Pairs Test, p |
|
| 1 | 2 | ||
| Регулярный n(%) | 109 (30,88%) | 293 (83%) | 0,001 |
| Продолжительность, дни | 44±19,51 | 31±12,04 | 0,001 |
| Характер кровянистых выделений | |||
| Обильные n(%) | 87 (24,65) | 34 (9,6) | 0,001 |
| Умеренные n(%) | 193 (54,67) | 296 (83,9) | 0,001 |
| Скудные n(%) | 68 (19,26) | 18 (5,1) | 0,001 |
Ко второму визиту МЦ стал регулярным у 293 (83%) пациенток, а средняя длительность МЦ составляла 31 (±12,04) дней. Характер маточных кровотечений во время менструации стал умеренным у 296 (83,9%) пациенток, сохранился обильным у 34 (9,6%), скудным у 18 (5,1%), также отсутствовал у 5 (1,42%). Характер ациклических кровотечений статистически значимо изменился и отсутствовал ко второму визиту у 326 (92,4%) пациенток, кровотечения стали скудными у 14 (3,97%), умеренными у 10 (28,35%), и были обильными у 3 (0,85%) пациенток.
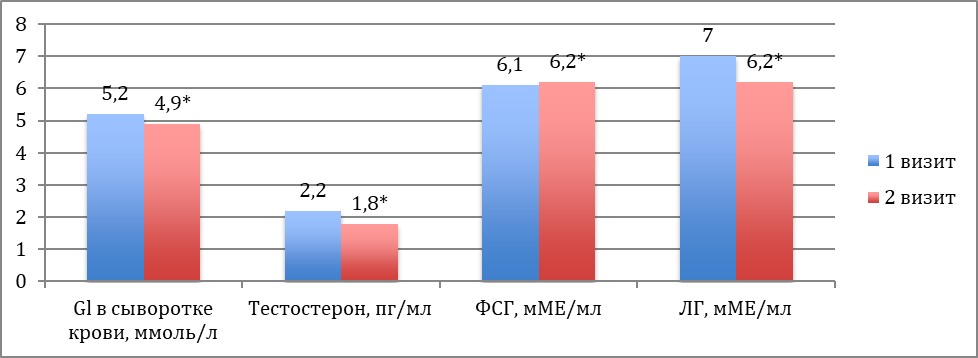
Рисунок 1. Результаты сравнительного анализа лабораторных показателей содержания глюкозы натощак, свободного тестостерона, ФСГ, ЛГ в сыворотке крови. * - р<0,05
При вторичном обследовании андрогенного статуса было установлено, что средний уровень свободного тестостерона снизился до 1,80 (±1,41) пг/л. Уровень ФСГ в среднем вырос до 6,2 (±6,5) мМЕ/мл, а уровень ЛГ снизился в среднем до 6,2 (±4,21) мМЕ/мл (рис.1).
Ко второму визиту уровень глюкозы натощак снизился на 0,3 ммоль/л и составлял в среднем 4,9±0,67ммоль/л (рис.1).
Заключение
Механизм влияния избыточной массы тела, метаболического синдрома и ожирения (особенно висцерального типа) на женскую репродуктивную систему в основном связано с избыточной продукцией лептина. Лептин действует на отдельные трансмембранные рецепторы цитокинов, называемые рецепторами лептина, участвующие в следующих процессах: регуляция потребления пищи и энергетического баланса путем воздействия на центры гипоталамуса; регуляция овариального фолликулогенеза; стимуляция секреции ГнРГ из гипоталамуса, ФСГ и ЛГ из гипофиза; повышение чувствительности к инсулину путем воздействия на секрецию ß-клеточного инсулина; стимуляция активного транспорта глюкозы и синтеза гликогена; регуляция метаболизма жирных кислот; регуляция многочисленных эндокринных функций, воспаления, иммунного ответа и ангиогенеза. Как повышение лептина, так и его снижение одинаково неблагоприятно влияют на репродуктивную систему, т.е. приводят к нарушению пульсирующей секреции ГнРГ с подавлением стероидогенеза яичников и нарушением ароматизации андрогенов в эстрогены в тека-клетках. Происходит нарушение репродуктивных функций. К этому прибавляется активность ароматаз в жировой ткани, образование катехолэстрогенов, в итоге – повышение риска развития рака эндометрия и рака молочной железы. Лептин – цитокин, ключевой модулятор жировой ткани. Чем больше пролиферация адипоцитов, тем интенсивнее выработка провоспалительных цитокинов, в частности, продукция лептина, которая регулируется и половыми стероидами и тестостероном. Таким образом, порочный круг: избыточная продукция андрогенов, периферическая конверсия в клетках жировой ткани, повышение продукции лептина, приводит к нарушению овуляции и репродуктивной функции. При ожирении соотношение эстрон/эстрадиол меняется в сторону повышения уровня эстрона и нарушается механизм обратной связи. Гиперэстрогенемия сенсибилизирует гонадотрофы гипофиза к ГнРГ и снижает пороговый уровень овариального эстрадиола, необходимого для начала овуляторного подъема ЛГ поэтому наиболее часто у женщин с избыточной массой тела, метаболическим синдромов, ожирением АМК имеют ановуляторный характер20, 21. Это наблюдалось и у обследованных женщин – средняя продолжительность цикла составляла 44±19,51 дня. После назначения МИ и ДХИ было значительное укорочение МЦ до его физиологических параметров – длительность 31±12,04, частота обильных кровянистых выделений уменьшилась в 2,57 раза, умеренных увеличилась в 1,62 раза, частота регулярного МЦ увеличилась в 2,69 раза. Это сопровождалось также снижением массы тела (-3 кг), уменьшением окружности талии (-2,5см). Лабораторные тесты показали снижение содержания глюкозы в сыворотке крови, снижение свободного тестостерона, увеличение ФСГ и снижение ЛГ. Результаты исследования позволяют рекомендовать у женщин с ожирением и избыточной массой тела, страдающих АМК-О в сочетании с комплексной терапией (диета, физическая нагрузка) средство Дикироген, содержащее МИ и ДХИ в соотношении 5:1.
- Munro M. G., Critchley H. O. D., Fraser I. S. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions //International Journal of Gynecology & Obstetrics. – 2018. – Т. 143. – №. 3. – С. 393-408.
- Warner, PE, Critchley, HO, Lumsden, MA, Campbell-Brown, M, Douglas, A, Murray, GD. Menorrhagia I: measured blood loss, clinical features, and outcome in women with heavy periods: a survey with follow-up data. Am. J. Obstet. Gynecol. 190(5), 1216–1223 (2004).
- Hurskainen R, Teperi J, Rissanen P, Aalto A, Grenman S, Kivel. A, et al. Clinical outcomes and costs with the levonorgestrel-releasing intrauterine system or hysterectomy for treatment of menorrhagia. Randomized trial 5-year follow-up. JAMA 2004; 219:1456-63.
- Tajjamal A., Zaman F. Severity of bleeding is a predictor of quality of life in women with heavy menstrual bleeding under dydrogesterone treatment in a prospective, multicenter, observational study//Gazz Med Ital-Arch Sci Med 2015; 174:391-8
- Karlsson, TS, Marions, LB, Edlund, MG. Heavy menstrual bleeding significantly affects quality of life. Acta Obstet. Gynecol. Scand. 93(1), 52–57 (2014).
- Jabbour, HN, Kelly, RW, Fraser, HM, Critchley, HO. Endocrine regulation of menstruation. Endocr. Rev. 27(1), 17–46 (2006).
- Hapangama DK, Bulmer JN. Pathophysiology of heavy menstrual bleeding. Women’s Health 2016; 12 (1): 3-13. doi: 10.2217/whe.15.81
- Соловьева А.В., Стуров В.Г. Анемии и репродуктивное здоровье/ под ред. В.Е. Радзинского. М: Status praesens. 2019. – 200 с.
- Munro M.G., Critchley H.O., Fraser I.S. The FIGO classification of causes of abnormal uterine bleeding in the reproductive years // Fertil. Steril. — 2011. — Vol. 95 (7). — Р. 2204–2208. [PMID: 21496802.]
- Симптом, синдром, диагноз. Дифференциальная диагностика в гинекологии. - 3-е изд., исправ. и доп. / Н. М. Подзолкова, О. Л. Глазкова. - М. : ГЭОТАР-Медиа, 2014. – 736
- Ожирение. Диабет. Беременность. Версии и контраверсии. Клинические практики. Перспективы/под ред. В.Е. Радзинского, Т.Л.Боташевой. – М.: ГЭОТАР-Медиа, 2020. – 528 с.
- Nouri M., Tavakkolian A., Mousavi S.R. Association of dysfunctional uterine bleeding with high body mass index and obesity as a main predisposing factor// Diabetes Metab Synd. Jan-Mar 2014; 8(1):1-2
- Nandi A, Chen Z, Patel R, Poretsky L. Polycystic ovary syndrome. Endocrinol. Metab. Clin. North. Am. 43(1), 123–147 (2014).
- Bray GA. The underlying basis for obesity: relationship to cancer. J. Nutr.132(Suppl. 11), S3451–S3455 (2002).
- Wojciechowska A, Osowski A, J.źwik M et al. Inositols' Importance in the Improvement of the Endocrine-Metabolic Profile in PCOS. Int J Mol Sci 2019; 20 (22): 5787. DOI: 10.3390/ijms20225787
- Larner J, Brautigan DL, Thorner MO. D-chiro-inositol glycans in insulin signaling and insulin resistance. Mol Med 2010; 16 (11–2): 543–52. DOI: 10.2119/molmed.2010.00107
- Торшин И.Ю., Майорова Л.А., Уварова Е.В. и др. Хемореактомный анализ стереоизомеров инозитола: различные профили фармакологического действия миоинозитола и D- хироинозитола при нарушениях женской репродуктивной системы. Вопр. акушерства, гинекологии и перинатологии. 2020; 5 (19): DOI: 10.20953/1726-1678-2020-5 [Torshin I.Iu., Maiorova L.A., Uvarova E.V. et al. Khemoreaktomnyi analiz stereoizomerov inozitola: razlichnye profili farmakologicheskogo deistviia mioinozitola i D-khiroinozitola pri narusheniiakh zhenskoi reproduktivnoi sistemy. Vopr. akusherstva, ginekologii i perinatologii. 2020; 5 (19): DOI: 10.20953/1726-1678-2020-5 (in Russian).]]
- Teede HJ, Misso ML, Costello MF et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril 2018; 110 (3): 364–79.
- Pintaudi B, Di Vieste G, Bonomo M. The Effectiveness of Myo-Inositol and D-Chiro Inositol Treatment in Type 2 Diabetes. Int J Endocrinol 2016; 2016: 9132052. DOI: 10.1155/2016/9132052
- Воронцова А.В., Гаспарян С.А., Громова О.А., и др. Обоснование применения средства Дикироген на основе инозитола у пациенток с нарушениями менструального цикла//Проблемы репродукции. – 2020, Т.26, №1, с. 44-53 https://doi.org/10.17116/repro20202601144
- Обоскалова Т.А. и соавт. Результаты применения кимбинации миоинозитола и Д-хироинозитола в соотношении 5:1 у женщин с синдромом поликистозных яичников //Гинекология. – 2020; 22 (6). https://doi.org/10.26442/20795696.2020.6.200548
-
 Производство Дикироген®
Производство Дикироген®
соответствует требованиям
надлежащей производственной
практики (GMP) -
 Произведено
Произведено
в Италии -
 Марка года
Марка года


